INTRODUCCIÓN.
Los compuestos orgánicos también son llamados química orgánica... Ciertamente este es un término bastante generalizado que pretende explicar la química de los compuestos que contienen carbono, excepto los carbonatos, cianuros y óxidos de carbono.
Muchas veces se creyó que los compuestos llamados orgánicos se producían solamente en los seres vivos como consecuencia de una fuerza vital que operaba en ellos, creencia que encontraba mucho apoyo ya que nadie había sintetizado algún compuesto orgánico en un laboratorio. Sin embargo en 1828, el químico alemán Friedrich Wohler (1800-1882) puso fin a la teoría vitalista cuando logro sintetizar urea haciendo reaccionar las sustancias inorgánicas conocidas como cianato de potasio y cloruro de amonio.
Los compuestos orgánicos son todas las especies químicas que en su composición contienen el elemento carbono y, usualmente, elementos tales como el Oxígeno (O), Hidrógeno (H), Fósforo (F), Cloro (CL), Yodo (I) y nitrógeno (N), con la excepción del anhídrido carbónico, los carbonatos y los cianuros.
Características de los Compuestos Orgánicos:
Son Combustibles
Poco Densos
Electro conductores
Poco Hidrosolubles
Pueden ser de origen natural u origen sintético
Tienen carbono
Casi siempre tienen hidrogeno
Componen la materia viva
Su enlace más fuerte en covalente
Presentan isomería
Existen más de 4 millones
Presentan concatenación
Propiedades de los Compuestos Orgánicos
En general, los compuestos orgánicos covalentes se distinguen de los compuestos inorgánicos en que tienen puntos de fusión y ebullición más bajos. Por ejemplo, el compuesto iónico cloruro de sodio (NaCl) tiene un punto de fusión de unos 800 °C, pero el tetracloruro de carbono (CCl4), molécula estrictamente covalente, tiene un punto de fusión de 76,7 °C. Entre esas temperaturas se puede fijar arbitrariamente una línea de unos 300 °C para distinguir la mayoría de los compuestos covalentes de los iónicos.
Gran parte de los compuestos orgánicos tienen los puntos de fusión y ebullición por debajo de los 300 °C, aunque existen excepciones. Por lo general, los compuestos orgánicos se disuelven en disolventes no polares (líquidos sin carga eléctrica localizada) como el octano o el tetracloruro de carbono, o en disolventes de baja polaridad, como los alcoholes, el ácido etanoico (ácido acético) y la propanona (acetona). Los compuestos orgánicos suelen ser insolubles en agua, un disolvente fuertemente polar.
Los hidrocarburos tienen densidades relativas bajas, con frecuencia alrededor de 0,8, pero los grupos funcionales pueden aumentar la densidad de los compuestos orgánicos. Sólo unos pocos compuestos orgánicos tienen densidades mayores de 1,2, y son generalmente aquéllos que contienen varios átomos de halógenos.
Los grupos funcionales capaces de formar enlaces de hidrógeno aumentan generalmente la viscosidad (resistencia a fluir). Por ejemplo, las viscosidades del etanol, 1,2-etanodiol (etilenglicol) y 1,2,3-propanotriol (glicerina) aumentan en ese orden. Estos compuestos contienen uno, dos y tres grupos OH respectivamente, que forman enlaces de hidrógeno fuertes.
CLASIFICACION DE LOS COMPUESTOS ORGÁNICOS
1. Primer documento para leer.
2. Segundo documento, para observar.
TIPOS DE FÓRMULAS USADOS EN QUÍMICA ORGÁNICA
NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS
1. Página con ejercicios.
Fórmulas químicas | |||||||||||||||||||||
La fórmula química es la forma escrita de una molécula. Debe proporcionar, como mínimo, dos informaciones importantes: qué elementos forman el compuesto y en qué proporción se encuentran dichos elementos en el mismo. La fórmula puede ser: Empírica: Es la fórmula más simple posible. Indica qué elementos forman la molécula y en qué proporción están. Es la fórmula que se obtiene a partir de la composición centesimal de un compuesto. Por ejemplo, si tenemos un hidrocarburo (formado por H y C) podemos combustionarlo en presencia de oxígeno, y a partir del CO2 y H2O que se forman determinar la cantidad de C e H que contiene. Bastará calcular los moles de C e H, y dividir estas dos cantidades por el valor más pequeño determinando la proporción de los átomos en el compuesto, es decir, su fórmula empírica. Ejemplo : CH, compuesto formado por carbono e hidrógeno, en la proporción: 1 a 1. Molecular: Indica el número total de átomos de cada elemento en la molécula. Para conocer la fórmula molecular a partir de la empírica es preciso conocer la masa molecular del compuesto. A partir de las propiedades coligativas, como presión osmótica, descenso crioscópico o aumento ebulloscópico, podemos determinar la masa molecular, y a partir de ésta la fórmula molecular con una simple proporción. Hay tres formas distintas de escribir una fórmula molecular:
Geométricas: Abrevian la escritura e indican la distribución de los átomos en el plano o en el espacio.
| |||||||||||||||||||||
Cadena carbonada | |||||||||||||||||||||
Es la secuencia de átomos de carbono, unidos entre sí, que forman el esqueleto de la molécula orgánica. Hay diferentes tipos de cadena, según sea a su forma: Abierta o acíclica: Los átomos de carbono extremos no están unidos entre sí. No forman anillos o ciclos. Puede ser:
Cerrada o cíclica: El último carbono de la cadena se une al primero, formando un ciclo o anillo. Hay varios tipos:
| |||||||||||||||||||||
Clases de átomos de carbono | |||||||||||||||||||||
| |||||||||||||||||||||
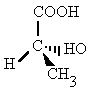
Isómeros | |||||||||||||||||||||
Se llaman isómeros a dos o más compuestos diferentes que tienen la misma fórmula molecular, pero diferente fórmula estructural, y diferentes propiedades físicas o químicas.
| |||||||||||||||||||||
Función química y grupo funcional | |||||||||||||||||||||
Se llama función química a cada grupo de compuestos con propiedades y comportamientos químicos característicos. Cada función se caracteriza por poseer un agregado, de uno o varios átomos, al que se denomina grupo funcional. Las funciones químicas que vamos a formular, con sus grupos funcionales, están en la siguiente tabla. | |||||||||||||||||||||
Nomenclatura | |||||||||||||||||||||
Es el conjunto de reglas que permiten asignar, unívocamente, un nombre a cada compuesto químico. Nomenclatura sistemática Es la que se ajusta a un sistema prefijado. Se deben seguir los convenios establecidos por la I.U.P.A.C. (Unión Internacional de Química Pura y Aplicada). En esta web: IUPAC Nomenclature of Organic Chemistry se recogen las recomendaciones de la IUPAC de 1979 y de 1993. Nomenclatura tradicional Arraigada en el lenguaje químico convencional, aún que no sigue unas normas prefijadas. Muchos de estos nombres tradicionales están aceptados por la IUPAC.
| |||||||||||||||||||||
Tomado de: http://www.alonsoformula.com/organica/conceptos.htm
DOCUMENTOS:
Profundiza: Los compuestos organicos
ACTIVIDADES:
Actividad: Nomenclatura orgánica
EVALUACIÓN: GRUPOS FUNCIONALES, FÓRMULAS QUÍMICAS, NOMENCLATURA GENERAL.
EVALUACIÓN: GRUPOS FUNCIONALES, FÓRMULAS QUÍMICAS, NOMENCLATURA GENERAL.
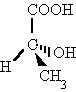
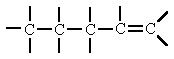
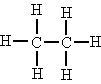 Los dos átomos de carbono son primarios
Los dos átomos de carbono son primarios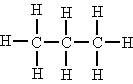 El átomo de carbono central es secundario.
El átomo de carbono central es secundario.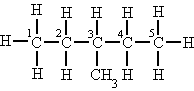 El átomo de carbono (3) es terciario.
El átomo de carbono (3) es terciario.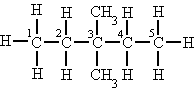 El átomo de carbono (3) es cuaternario.
El átomo de carbono (3) es cuaternario. 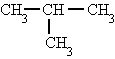
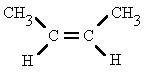
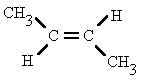
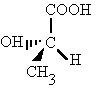
No hay comentarios:
Publicar un comentario